2017 国际同行评审会议报告:科研刊物的报告质量

【意得辑企业沟通经理 Hridey Manghwani 正在美国芝加哥出席 2017 国际同行评审会议,以下是由 Hridey 观点写成的第二天会议报告。】
在 Ottawa Hospital Research Institute 的 David Moher 的主题演讲结束后,第八届国际同行评审和科研发表会议第二天的议程便正式展开,今天的重点是报告质量。渥太华大学 Robert Frank 报告了他所属团队的研究,分析影像研究中错误结果相关的变量。荟萃分析 (meta analyses, MAs) 是影像研究中最接近真实的代表,团队研究了研究层级(相对 STARD 的引用率、发表顺序和发表时间)和期刊层级的变量(影响因子、STARD 认可和引用半衰期)与 MAs 中主要研究结果和概要估计间的距离的关系。在分析了 98 篇包含 1458 个主要研究的 MAs 后,得出以下结论,发表在影响因子 (IF) 较低的期刊的 MAs 中主要研究结果和概要估计间的距离并不小于发表在高影响因子期刊上的研究。他们的结论再次强调高影响因子和高引用率并不代表研究质量比较好。

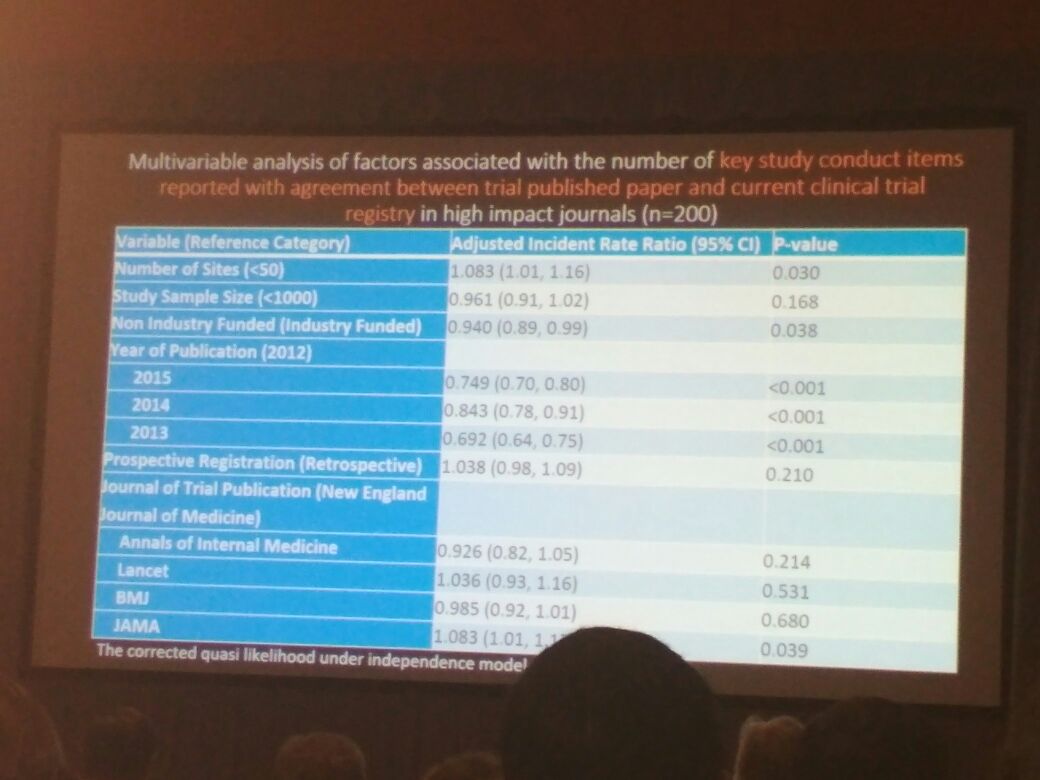
接下来是加拿大麦克马斯特大学、Toronto General Hospital Health Network 的 Sarah Daisy Kosa 带来的研究:发表的试验数据与发表在高影响因子期刊上的已注册临床试验间的差距,她的团队在 PubMed 上检索 2012 至 2015 年间,所有发表在影响因子排名前五的医学期刊(根据 2014 汤森路透期刊引证报告)上的随机临床试验 (randomized clinical trials, RCTs),在团队研究 200 份 RCT 中,发现发表文章和临床试验注册存在差距,研究清楚指出,要保持科学研究质量与诚信,需要统一发表的临床数据报告和注册。
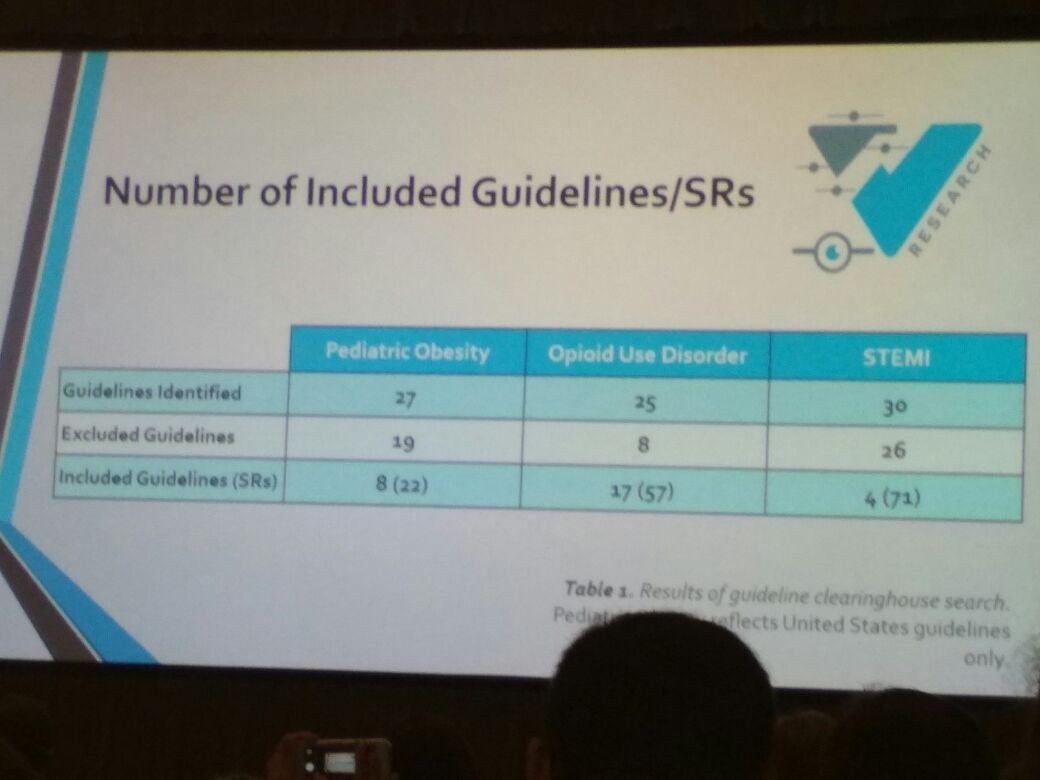
接着,美国俄克拉荷马州立大学健康科学中心的 Cole Wayant 在临床实践指南的准则上,讨论了系统综述 (systematic reviews, SRs) 方法和报告的质量。他的研究用 PRISMA (Preferred Reporting Items for Systematic Reviews and Meta-analyses) 和 AMSTAR (A Measurement tool to assess Systematic Reviews) 分析了 MAs 和 SRs,研究结果显示 MAs 和 SRs 皆缺少这些检查清单中的许多项目,凸显需要提升 SRs 质量的必要性,特别是 SRs 属于 1A 等级证据,可以影响临床决策,进而影响循证医学。
最后或许也是互动性最强的课堂是由美国加利福尼亚大学住院医师 Kaveh Zakeri 带来的简报,他的研究分析了当前 National Clinical Trials Network 3 期试验存有的乐观偏见。Zakeri 的团队从 PubMed 找出 2007 年 1 月至 2017 年 1 月间 185 篇 3 期随机对照临床试验,比较提出的效应量和观察到的效应量,他们计算了两者风险比 (hazard ratios, HRs),风险比具有比较高的治疗效果和减少不良反应指标性,结果显示大部分 NCI 资助的 3 期试验的新疗法并没有达到统计显著性。他们建议,虽然乐观偏见的幅度已经比 1955 至 2006 年的试验减少,但临床试验 protocol 还是需要更合理地提出效应量。许多窄门领域中的试验无法重复,甚至因为无法招募到足够的病患导致样本量极小,大部分 2 期和 3 期的试验对提出的效应量都没有合理的说明。
我们将在下一篇会议报告中报告下午的议程,下午的议程讨论了科研文献、试验注册和基金审查。
意得辑专家视点 2017 国际同行评审会议报告:






